Der zweite Hauptsatz der Thermodynamik

Wir alle wissen, dass ein erhitztes Rad sich nicht von selbst drehen würde – auch wenn dies durch die Energieerhaltung möglich wäre. Es ist nicht unmöglich, jedoch sehr, ja höchst unwahrscheinlich. Andrerseits wandelt eine Dampfmaschine Hitze in Arbeit um. Die wichtige Frage „In welchem Ausmaß kann Hitze in Arbeit umgewandelt werden?“ wird vom zweiten Hauptsatz der Thermodynamik beantwortet, zweifellos dem wichtigsten der drei Hauptsätze.
Dieser Hauptsatz wird in dem berühmten Aufsatz „Zwei Kulturen“ von C.P.Snow aus dem Jahr 1956 dargestellt; Snow kritisiert öffentlich die wissenschaftliche Unwissenheit gebildeter Leute, indem er die Tatsache feststellt, dass praktisch jeder ein Stück von Shakespeare kennt, aber praktisch niemand weiß, worum es im – gleichermaßen wichtigen – zweiten Hauptsatz der Thermodynamik geht!
Kelvins Formulierung dieses Hauptsatzes sagt aus, dass es keinen thermodynamischen Prozess gibt, dessen einziger Effekt sei, Hitze aus einem Reservoir zu entziehen und sie komplett in Arbeit umzuwandeln. Dies kann umformuliert werden, indem man sagt, dass ein idealer Motor prinzipiell nicht existieren kann. Dies muss einem echten Motor gegenüber gestellt werden, welcher eine Maschine ist, die einen Zyklus von thermodynamischen Zuständen durchläuft und Hitze in Arbeit umwandelt. Gleichzeitig muss sie einen Teil der entnommenen Hitze an die Umgebung abgeben.
Der zweite Hauptsatz beinhaltet den Begriff der Entropie, welche eine Zustandsgröße wie die Temperatur ist. Sie ist jedoch heikel, weil man sie nicht direkt messen kann. Hinsichtlich der Entropie legt der zweite Hauptsatz der Thermodynamik fest, dass die Entropie bei einem beliebigen Prozess innerhalb eines geschlossenen Systems nicht abnehmen kann.
Entropie ist ein Maß für die Unordnung eines Systems. Diese Definition ergibt sich präzise, wenn man den statistischen Zusammenhang mit den zugänglichen Zuständen eines Systems auf mikroskopischer Ebene untersucht. Auf dem Gebiet der statistischen Mechanik kann man begründen, dass die Entropie in einem geschlossenen System, das nicht im Gleichgewicht ist, solange ansteigt, bis sie ein Maximum im Gleichgewicht erreicht. Das ist im Prinzip eine Folge der Bestrebung „dass etwas von einem weniger wahrscheinlichen in einen wahrscheinlicheren Zustand übergeht“.
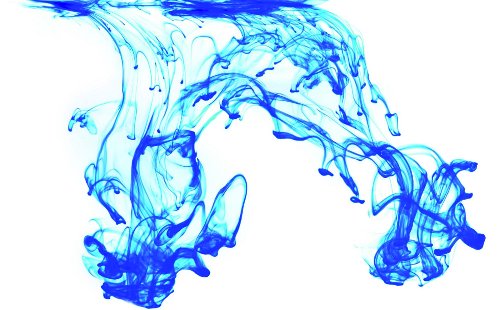
Wenn ein Tintentropfen in einen Behälter voll Wasser fällt, dann werden die Tintenmoleküle sich verteilen und im Wasser verbreiten, bis sie den Gleichgewichtszustand erreicht haben, in dem die Moleküle gleichmäßig im ganzen Behälter verteilt sind. Der umgekehrte Prozess wird sicherlich nicht geschehen, mit Sicherheit nicht spontan.
Miniwörterbuch
Die Unordnung = Disordine
Die Entropie = Entropia
Die Umgebung, die Umwelt = Ambiente
Das Reservoir, s = Sorgente
Die Dampfmaschine, n = Macchina a vapore
Die Thermodynamik = Termodinamica

