La deuxième loi de la thermodynamique
Tout le monde sait que même si une roue est réchauffée, elle ne se mettra pas à tourner toute seule, même si la conservation de l’énergie le lui permettrait. Ce n’est pas impossible, mais c’est vraiment très improbable. Par contre, une machine à vapeur réussit à transformer la chaleur en mouvement. La question importante «dans quelle mesure la chaleur peut-elle être transformée en mouvement?» trouve une réponse dans la deuxième loi de la thermodynamique, sans aucun doute la plus célèbre des trois lois.
Cette loi se trouve dans le célèbre essai Les deux cultures par C.P.Snow, publié en 1956, dans lequel Snow critiquait publiquement l’analphabétisme scientifique des personnes cultivées, en observant que presque tout le monde connaît une comédie de Shakespeare, mais presque personne ne sait de quoi parle le – tout aussi important – deuxième principe de la thermodynamique!
Dans la formulation de ce principe Kelvin affirme qu’il n’y a aucun procédé thermodynamique qui ait l’effet unique d’extraire la chaleur d’un réservoir pour la convertir entièrement en mouvement. Ce principe peut être paraphrasé en disant qu’un moteur idéal n’existe pas, par principe. Il doit être comparé avec un vrai moteur, c’est-à-dire une machine qui passe à travers un cycle d’états thermodynamiques et qui transforme la chaleur en mouvement, mais qui libère – en même temps – une partie de la chaleur dans l’environnement.
Le deuxième principe concerne la notion d’entropie, qui est un état variable comme la température, mais plus subtil, parce que l’on ne peut pas le mesurer directement. Concernant l’entropie, la deuxième loi de la thermodynamique affirme que pour chaque processus se produisant dans un système fermé, l’entropie ne peut pas diminuer.
L’entropie est une mesure du désordre dans un système. Cette définition peut devenir rigoureuse si on étudie la connexion statistique des états accessibles du système au niveau microscopique. Dans le domaine de la mécanique statique, on peut établir que dans un système fermé qui n’est pas en équilibre, l’entropie augmente jusqu’à atteindre un maximum en équilibre. Ceci est fondamentalement une conséquence de la tendance à «aller d’un état moins probable à un état plus probable».
[Adapté de S. Bais, Le equazioni. Icone di conoscenza, Harvard University Press, 2005]

William Thomson, 1er Baron Kelvin (1824-1907)
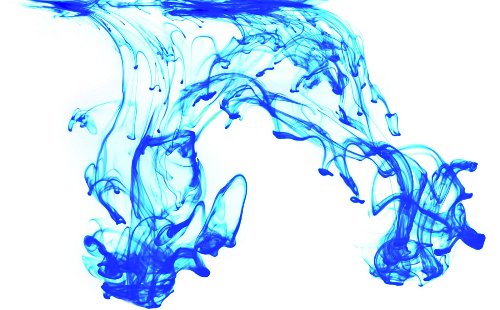
Si l’on fait tomber une goutte d’encre dans un récipient plein d’eau, les molécules d’encre se disperseront et se répandront dans l’eau avant de rejoindre la situation d’équilibre dans laquelle les molécules seront distribuées de façon uniforme dans tout le récipient. De toute évidence, le processus opposé ne se produira pas, du moins pas de façon spontanée.
Vocabulaire
Atteindre = Raggiungere
Comparer = Paragonare
Domaine = Ambito
Encre = Inchiostro
États accessibles = Disordine
Façon = Modo
Fermé = Chiuso
Réservoir = Sorgente
Subtil = Sottile

